
IAHR
CIC
XX SEMINARIO NACIONAL DE HIDRÁULICA E HIDROLOGÍA
BARRANQUILLA, COLOMBIA, 8 AL 10 DE AGOSTO DE 2012
Factores que Favorecen la Generación y Crecimiento de Algas en Redes de
Distribución de Agua Potable
Sara C. Gacharná y Juan G. Saldarriaga
Centro de Investigaciones en Acueductos y Alcantarillados (CIACUA), Departamento de Ingeniería Civil y Ambiental,
Universidad de los Andes, Bogotá, Colombia
<sc.gacharna41@uniandes.edu.co>, <jsaldarr@uniandes.edu.co>
RESUMEN
Las redes de distribución de agua potable (RDAP) requieren un cierto nivel de mantenimiento, por
esto una inadecuada desinfección puede llevar al crecimiento de microorganismos. Hoy en día, las
nuevas tuberías de PVC son blancas y pueden llegar a ser transparentes dejando pasar la luz solar,
permitiendo la generación de algas y cianobacterias. Resulta de gran importancia determinar si se
produce el crecimiento de estos organismos bajo ciertas condiciones y de esta manera entender el
efecto hidráulico de este crecimiento en RDAP. Para llevar a cabo este estudio se utilizó un
montaje de recirculación que simula las condiciones de una RDAP. Para ello se mantuvo
desinfectado el sistema y el agua se recirculó constantemente. Además, el tanque fue alimentado
con fosfato diámonico (DAP) para proporcionar los nutrientes suficientes. Para poder evaluar el
crecimiento de estos organismos se realizó una Microscopía Electrónica de Barrido (MEB) y se
hicieron 2 pruebas hidráulicas semanales durante 82 días. Al finalizar esta investigación no se
evidenció crecimiento de algas y cianobacterias en la superficie interna de la tubería, resultados que
son coherentes con los hidráulicos. Paralelamente se logró establecer que la rugosidad calculada con
las ecuaciones tradicionales no es confiable pues actualmente los materiales están fabricados con
una nueva tecnología que los hace cada vez más lisos, por lo tanto estos análisis no reflejan la
rugosidad real.
PALABRAS CLAVES: Algas, redes de distribución de agua potable, Rugosidad.

INTRODUCCIÓN
Problemática actual
Las redes de distribución de agua potable son sistemas de tuberías complejos que requieren un
cierto nivel de mantenimiento. Al minimizar los costos de operación de mantenimiento a la RDAP
puede causar el desarrollo de biopelículas, y crecimiento de algas y cianobacterias. Para complicar
las cosas, algunas tuberías de PVC blancas son transparentes a la luz solar, proporcionando luz para
ayudar al crecimiento de las algas y a las cianobacterias. Nutrientes más luz solar pueden causar
desarrollo de estos organismos en sistemas de distribución de agua potable. Las algas y
cianobacterias se acumulan en las paredes de las tuberías y luego una vez que éstas se establecen en
el sistema de tuberías son difíciles de quitar sin costosos químicos y limpieza a fondo (Clark et al.,
1996).
Lo que permite el crecimiento y desarrollo de algas y cianobacterias dentro de los sistemas
de distribución de agua potable es la disponibilidad de nutrientes que se transporta en ella. Esta
contaminación se debe a diferentes actividades humanas que han llevado a la fertilización excesiva
de muchos cuerpos de agua, lo que conlleva a una proliferación excesiva de algas y cianobacterias
de agua dulce (WHO, 2003).
Es así como resulta de gran importancia, tratar de recrear el ambiente de las redes de
acueducto lo más cercano posible a la realidad para establecer los factores tanto ambientales como
hidráulicos que influyen en el desarrollo de las mismas. Por lo tanto, el objetivo de este estudio fue
determinar si en una tubería de PVC blanco bajo condiciones de luz solar puede efectuarse el
crecimiento de algas y de esta manera entender el efecto hidráulico del crecimiento de algas en
sistemas de distribución de agua potable.
Algas y Cianobacterias
El término cianobacteria se refiere a organismos unicelulares, microscópicos, algunos de los cuales
forman colonias y así llegan a tamaños visibles a simple vista como partículas diminutas de color
verde-azul. Estos organismos están usualmente finamente dispersos a través del agua y pueden
causar turbidez considerable si alcanzan altas densidades. Al igual que las cianobacterias, algunos
tipos de algas son unicelulares; este es el caso de las Diatomeas. Además, un gran número de
especies de algas son organismos macroscópicos y multicelulares que pueden llegar a crecer e
incluso alcanzar cientos de metros (Van den Hoek et al., 1995). Las algas y cianobacterias se
encuentran en abundancia tanto en condiciones ambientales normales como en medios extremos de
temperatura, pH, concentración salina, y radiación (Seckbach, 2007).
Desarrollo de algas y cianobacterias en RDAP
Las cianobacterias se encuentran entre los organismos más primitivos de la tierra, pues su origen se
estima hace unos 3500 millones de años. El crecimiento de cianobacterias y las algas está ligado,
invariablemente, a la eutrofización de las aguas. Las dos sustancias consideradas como las más
importantes en este crecimiento son compuestos nitrogenados y fosfatos. Éstos junto con el dióxido
de carbono, son generalmente las materias primas cuya disponibilidad determina la cantidad y
calidad del crecimiento de estos organismos (Geldreich, 1996).
Este crecimiento puede afectar el agua potable pues la mayoría de los componentes en las
redes de distribución pueden llegar a ser excelentes entornos microbianos. Sin embargo, la
persistencia y la proliferación de microorganismos en estos sistemas están influenciadas por varios
factores (Geldreich, 1996). La mayoría de las superficies expuestas son colonizadas por
microorganismos que forman biopelículas (Ridgway & Olson, 1981).
Existen datos que muestran el desarrollo de biopelículas que contienen algas y
cianobacterias (Allen et al., 1980). Por esta razón, las algas y las cianobacterias han sido implicadas
en la producción de sedimentos en los suministros de aguas industriales, causando coloración del

agua, induciendo la corrosión de concreto y de metales, reduciendo la potabilidad del agua tratada
por su presencia en los sistemas de distribución, interfiriendo con el tratamiento químico del agua, y
causando enfermedades en humanos y animales (Matheson, 1952).
Como la mayoría de las algas no pueden crecer y multiplicarse sin luz, las únicas algas que
pueden ser encontradas en las tuberías de los sistemas de distribución serían en primer lugar,
aquellas que no se remueven en el proceso de tratamiento, en segundo lugar, aquellas que tienen la
capacidad de crecer en la oscuridad; y tercero, las que se desarrollan en un depósito descubierto que
contenga agua tratada.
Finalmente, se estima que los actuales tratamientos de agua no son 100% eficaces en la
eliminación de las algas y cianobacterias (Steynberg et al., 1998; Steynberg et al., 1996). Por esta
razón algunas de ellas son capaces de penetrar en los sistemas de agua potable. Puesto que las algas
pueden viajar por todo el camino desde el origen hasta el punto final, los niveles detectados en el
agua de la llave son exclusivamente de algas que no se eliminan por el tratamiento (Codony et al.,
2003).
Factores que determinan el crecimiento de algas y cianobacterias
La disponibilidad de nutrientes, luz, y una mezcla de condiciones como el tiempo de residencia del
agua, la temperatura, las condiciones hidráulicas, material de la tubería, tipo y concentración del
desinfectante, y características físicas de las algas, son unos de los mayores determinantes del
crecimiento en los sistemás de distribución de agua potable. La interacción de estos factores son
complejos y variables, y a su vez pueden determinar la biomasa y la composición de estos
organismos a lo largo de la RDAP.
Evidencia del crecimiento de alga y cianobacterias en RDAP
Existen varios estudios en los cuales se ha encontrado evidencia del crecimiento de algas en los
sistemas de distribución de agua. En un principio este problema se ha venido presentando con una
mayor recurrencia en los sistemas de irrigación o de riego en el sector agrícola. En ellos se
demuestra que debido al espesor de los tubos de PVC blancos, estos permiten la filtración de luz
solar y en ellos se puede establecer el crecimiento de algas (Clark et al., 1996).
No obstante este ha sido un campo poco estudiado al interior de los sistemas de distribución
de agua potable, porque aunque hay crecimiento de algas este es muy limitado; en los últimos años
se han realizado unas investigaciones que han arrojado resultados positivos en cuando el
crecimiento de estos organismos.
Actualmente hay dos estudios sobre la presencia de algas o sus toxinas en biopelículas en
tuberías de agua potable. Estos estudios, utilizando microscopía electrónica de barrido en una
superficie de la tubería, encontraron fragmentos de diatomeas y otros fragmentos de algas o
“microfósiles” embebidos o incrustados en la biopelícula. Por otra parte, otros autores han
encontrado que algunas algas pueden crecer heterotróficamente en la oscuridad, y se han encontrado
cianobacterias en bajos niveles en aguas subterráneas. Además, las toxinas de las algas se
mantienen relativamente estables en la oscuridad, y pueden durar por lo menos una semana en el
agua (EPA, 2002).
Adicionalmente, en España se llevó a cabo el análisis de agua de la llave y en éste se
encontró evidencia del crecimiento de algas. En esta investigación experimental se aislaron cepas
de cianobacterias que se encuentran dentro del grupo Cyanophyta. En él se tomaron muestras de
agua directamente de la llave, luego se realizó filtración por membrana de las muestras
correspondientes y se llevaron a incubar en medio R2A. Allí se estableció que efectivamente hay
crecimiento de estos organismos en los sistemas de distribución de agua potable. Este fenómeno se
puede deber a la circulación del agua y a la resistencia de estos microorganismos a los
desinfectantes como el cloro, por medio de las esporas (Codony et al., 2003).
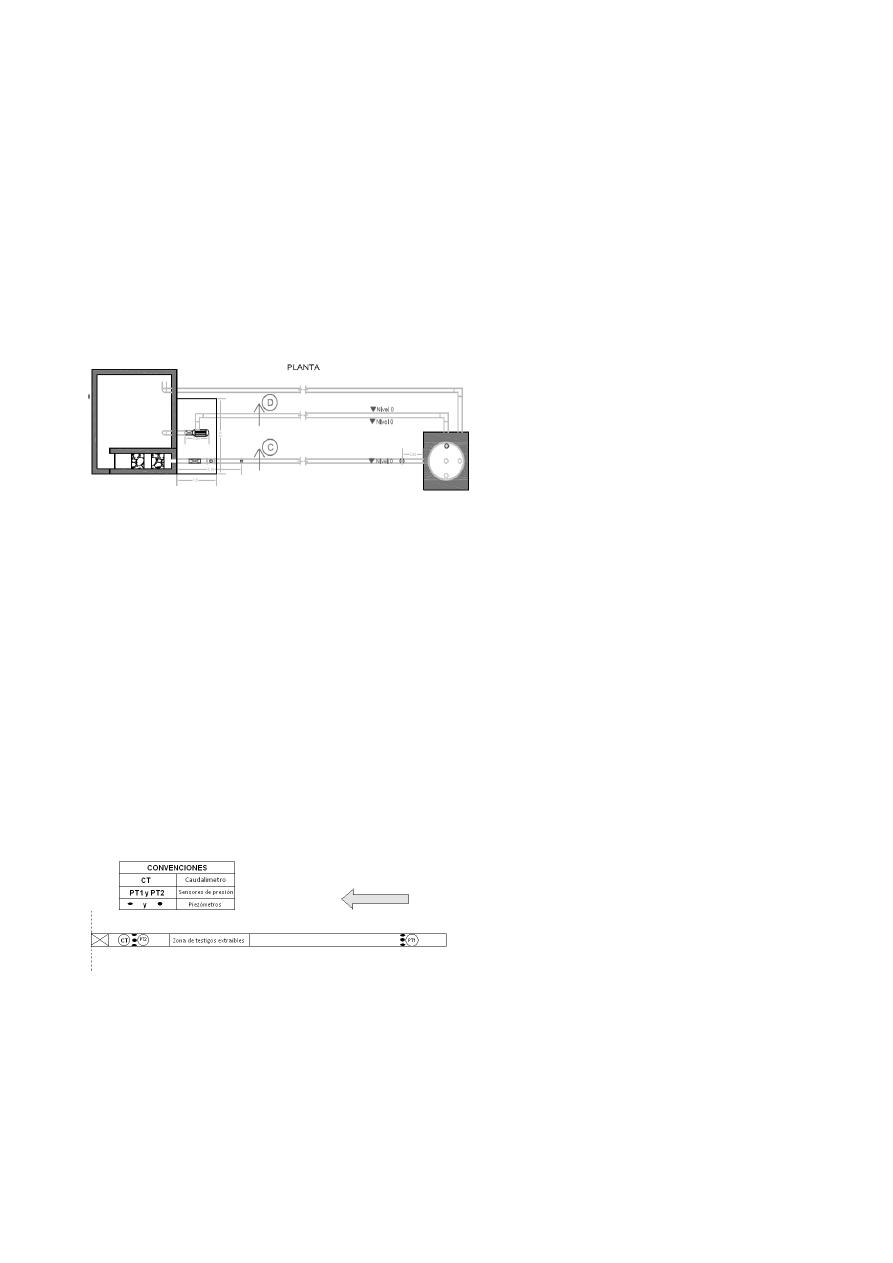
Figura 1.- Vista en planta del modelo.
MODELO FÍSICO
A fin de simular las características de una RDAP y cumplir con el objetivo del estudio se usó un
montaje de recirculación en el cual fue posible medir las pérdidas por fricción en la tubería y
evaluar generación y el crecimiento de algas y cianobacterias.
El modelo utilizado se encuentra constituido por dos tanques (un tanque de almacenamiento
y un tanque elevado vertical), los cuales están conectados entre sí por una tubería. El sistema de
tubería usado es: un tubo de PVC Biaxial de 80 metros de longitud sin uniones y 6 pulgadas de
diámetro nominal. Esta tubería de PVC cuenta con un diámetro exterior de 168.28 mm, un diámetro
interior de 159.04 mm y un espesor de pared de 4.62 mm.
En la Figura 1 se muestra el
esquema general del modelo, así como su
vista en planta:
Como se aprecia en la Figura 1 la tubería
sale del tanque elevado número 1 (tanque
elevado)
y
llega
al
tanque
de
almacenamiento. El tanque elevado es el
encargado de suministrar una altura
piezométrica suficiente para poder alcanzar
las velocidades requeridas para realizar las
pruebas. El tanque de llegada o tanque de almacenamiento, construido en concreto, recibe la
descarga de agua proveniente de la tubería para luego ser recirculada hacia el tanque elevado por
medio de una motobomba. En el tanque de llegada, la tubería se conecta a un vertedero rectangular
con el cual se puede medir el caudal que está fluyendo a través del mismo.
La tubería, al final, tiene una válvula de control de caudal que se encuentra a 0,53 m de la
llegada del tubo al tanque de almacenamiento. Aguas arriba de la válvula, se encuentra un tramo de
tubería aproximadamente de 1,07 m en el cual se encuentra ubicado el caudalímetro y luego a 0,98
m se halla situado el sensor de presión.
Aspectos hidráulicos
Para evaluar los aspectos hidráulicos, el sistema está provisto de tres piezómetros ubicados tanto al
comienzo como al final de la tubería al lado de las mangueras que se conectan al sensor de presión
(Figura 2), mediante los cuales es posible determinar las pérdidas por fricción y además hacer una
comparación entre unos datos manuales como automatizados. Un posible crecimiento de algas
incrementaría estas pérdidas por fricción. Los piezómetros se encuentran ubicados a una distancia
de 66,08 metros entre ellos. El sensor
diferencial de presión se encuentra ubicado
aguas abajo de la tubería. A este se le
conectaron dos mangueras; una manguera
ubicada aguas abajo de una rejilla que permite
alcanzar un flujo turbulento hidráulicamente
liso, y otra manguera aguas arriba de los
testigos extraíbles.
Con el fin de determinar el efecto que tienen las algas y las cianobacterias en las pérdidas
por fricción, se tomaron lecturas piezométricas y del sensor de presión aproximadamente de dos
veces a la semana.
Para calcular las pérdidas por fricción y pérdidas menores se realizaron 17 pruebas para cada
toma de datos, variando el caudal de tal forma que se pudieron obtener diferentes valores del
Figura 2.- Distribución de los piezómetros en la tubería.

número de Reynolds. De esta manera, se puedo conocer la rugosidad relativa de la tubería y por
consiguiente se pudo determinar si ésta se ve afectada a lo largo del estudio por el crecimiento de la
película de algas.
Aspectos microbiológicos
Para llevar a cabo la medición cualitativa de las algas fue necesario la instalación de testigos
extraíbles en los últimos tres metros de la tubería, con los cuales se pudo efectuar el análisis de
crecimiento progresivo de la película de algas al interior de la tubería de PVC.
Para realizar la determinación cualitativa del crecimiento de algas en la tubería, se realizaron
dos metodologías. La primera consistió en instalar un testigo extraíble aguas abajo de la tubería
(testigo de borde), el cual se asegura de tal forma que permita su fácil extracción. Este testigo es
una sección extraída de la misma tubería que coincide con el orificio realizado y que permanece
sumergido en el agua por el diámetro interno, mientras que por el diámetro externo se encuentra
sujeto a una tapa cuyo diámetro interno es igual al externo del mismo. Adicionalmente, se
instalaron dos abrazaderas en la parte exterior de cada tapa, para evitar que la presión interna
desprendiera el testigo.
La segunda metodología consistió en tener testigos de centro, al mismo tiempo con el testigo
de borde de la primera metodología; estos testigos de centro están formados por unos agujeros
rectangulares en la parte superior de cada una de las tuberías, en donde las partes del material
extraídas fueron fijadas al igual que el testigo de borde a unas tapas más grandes y estas fueron
fijadas a su vez a unas abrazaderas. Estos testigos fueron instalados aguas arriba del testigo de
borde, a fin de no alterar la medición de las pérdidas de energía (Figura 3).
Figura 3.-Testigos extraíbles.
DISEÑO EXPERIMENTAL
Suministro de nutrientes
A fin de favorecer el crecimiento de las algas en la tubería, es necesario suministrar la cantidad
apropiada de nutrientes.
A lo largo de la investigación se añadieron 55.63 gramos de fosfato diamónico (DAP), cuya
fórmula química es (NH
4
)
2
PO
4
, cada ocho días en el tanque de almacenamiento, a fin de cumplir los
requerimientos mínimos de nutrientes. A medida que fue progresando el estudio, se empezó a
observar el desarrollo y crecimiento de algas en distintas estructuras del montaje con excepción de
la tubería, por lo tanto la dosis de DAP no fue modificada. Mediante el empleo de estos nutrientes,
fue posible simular las condiciones de crecimiento de algas que en un sistema real de distribución
de agua potable se produciría en períodos muy largos.
Recirculación diaria
A fin de lograr un crecimiento de algas la tubería del montaje, el agua se recirculó diariamente
durante un periodo de 8 horas, tratando de simular un sistema de distribución de agua a presión. La
recirculación del sistema se realizó con una apertura mínima de las válvulas de control de caudal,
garantizando una velocidad aproximada de 0.5 m/s. Esta velocidad permitió en tesis anteriores el
crecimiento de biopelículas, por lo tanto se usó como referencia para permitir el crecimiento de las
algas y cianobacterias.

Mantenimiento del cloro residual libre mínimo en el sistema
Para la cloración del sistema se decidió usar hipoclorito de calcio HTH granular. Como la idea era
simular un sistema de distribución de agua potable, fue necesario mantener una concentración de
cloro mínimo dentro del modelo; según el RAS la concentración de cloro residual libre aceptable
dentro de cualquier punto de la red es de 0.3 – 2 mg/L. Partiendo de esto, se decidió mantener una
concentración de 0.5 mg/L para el diseño experimental de estudio.
Pruebas microbiólogicas: Microscopía Electrónica de Barrido (MEB)
Se realizó Microscopía Electrónica de Barrido (MEB), utilizando el microscopio electrónico de
barrido de La Universidad de los Andes. Para ello se tomaron muestras de la superficie interna de
los testigos, usando el método de escobillón, para llevarlas a observación. También se tomaron
muestras de las paredes del tanque de almacenamiento, de las estructuras de disipación (llamados
gaviones), y además se realizaron análisis a muestras de agua tanto del tanque de almacenamiento
como de la tubería de 6”.
Para realizar la observación en el microscopio se utilizó el método de platina de
enfriamiento. Este método consiste en un portamuestras de temperatura controlada que al acoplarse
al microscopio permite enfriar/calentar la muestra en un intervalo de temperatura que va desde -
25
o
C hasta +50
o
C a 300 Pa (Laboratorio de Caracterización MEB). Este método es muy útil en
microscopios de presión variable o de bajo vacío, en los cuales se hace necesario controlar la
evaporación del agua de las muestras húmedas, como las tomadas para este estudio, ya que
mediante el enfriamiento de éstas, la evaporación del agua puede hacerse más lenta o detenerse
completamente dependiendo de la presión en la cámara (Laboratorio de Caracterización MEB).
RESULTADOS
Los resultados corresponden a los datos tomados durante 12 semanas, exactamente 82 días de
recirculación del montaje.
Pruebas microbiólogicas
Para el análisis microbiológico MEB se procedió a tomar muestras de los testigos extraíbles y
demás estructuras del montaje.
Pared del tanque de almacenamiento
En la Figura 4 se pueden observar estructuras de algas de agua dulce. Esta microfotografía
corresponde a una muestra tomada de la pared del tanque de almacenamiento, ubicada cerca al
vertedero. En ella se puede ver filamentos alargados muy uniformes que parecen ser de la
cianobacteria Phormidium (Figura 5). Estos organismos son similares en morfología a Lyngbya y
Oscillatoria. Los filamentos son largos, cilíndricos, y pueden ser curvados o en forma de espiral.
Finalmente, estas estructuras son delgadas y firmes (The Silica Secchi Disk Database).
Figura 4.-Estructuras de algas, muestra
tomada de pared del tanque de
almacenamiento.
Figura 5.-Phormidium kützing: cianobacteria
larga y cilíndrica, que puede ser curvada o en
forma de espiral.
Estructuras de disipación de energía
En la Figura 6 se puede observar una microfotografía
tomada a las muestras tomadas del gavión 1 del montaje.
En la imagen se puede ver las mismas estructuras que se
encontraron en la muestra anterior de la pared del tanque
(Figura 4). Además, de esas estructuras, se puede
observar diatomeas, las cuales se pueden identificar
absolutamente por su morfología característica (Figura 6).
Estas células se agrupan en colonias unidas por un
material mucilaginoso que estas secretan a través de sus
poros (The Silica Secchi Disk Database).
Testigos extraíbles, de centro y de borde
En la Figura 7 se puede observar la muestra tomada del testigo de borde en donde se aprecian
estructuras que se pueden deber al enfriamiento de la muestra, en donde se congela todo el
espécimen. Estas formas pueden deberse a restos de agua congelada, pero también pueden ser
estructuras pertenecientes a algún tipo de hongo
filamentoso, o alguna cianobacteria. Además, al
realizar la toma de muestras, usando el método
de escobillón a cada testigo, no se observó una
película bacteriana, de algas o de cianobacterias,
a simple vista. La posible ausencia de
microorganismos en la superficie interna de la
tubería puede ser la razón por la cual no hay
evidencia de algún microorganismo en varias de
las fotografías que fueron tomadas a la
microscopía realizada en los testigos.
Pruebas hidráulicas
Durante el tiempo de recirculación del agua en el montaje, se tomaron 2 lecturas piezométricas
semanales. Simultáneamente se tomaron lecturas automáticas en el programa de computador, tanto
del sensor diferencial de presión como del caudalímetro; esto para cada uno de los caudales que se
probaron. Además se midió la altura de la lámina de agua del vertedero y la temperatura. Con esta
información se calculó el factor de fricción (f) en cada medición y el número de Reynolds, que
posteriormente fueron ubicados en el Diagrama de Moody. De esta manera se pudo conocer la
rugosidad de la tubería, observando si esta presentó alguna variación durante el tiempo de estudio a
causa del crecimiento de las algas o cianobacterias.
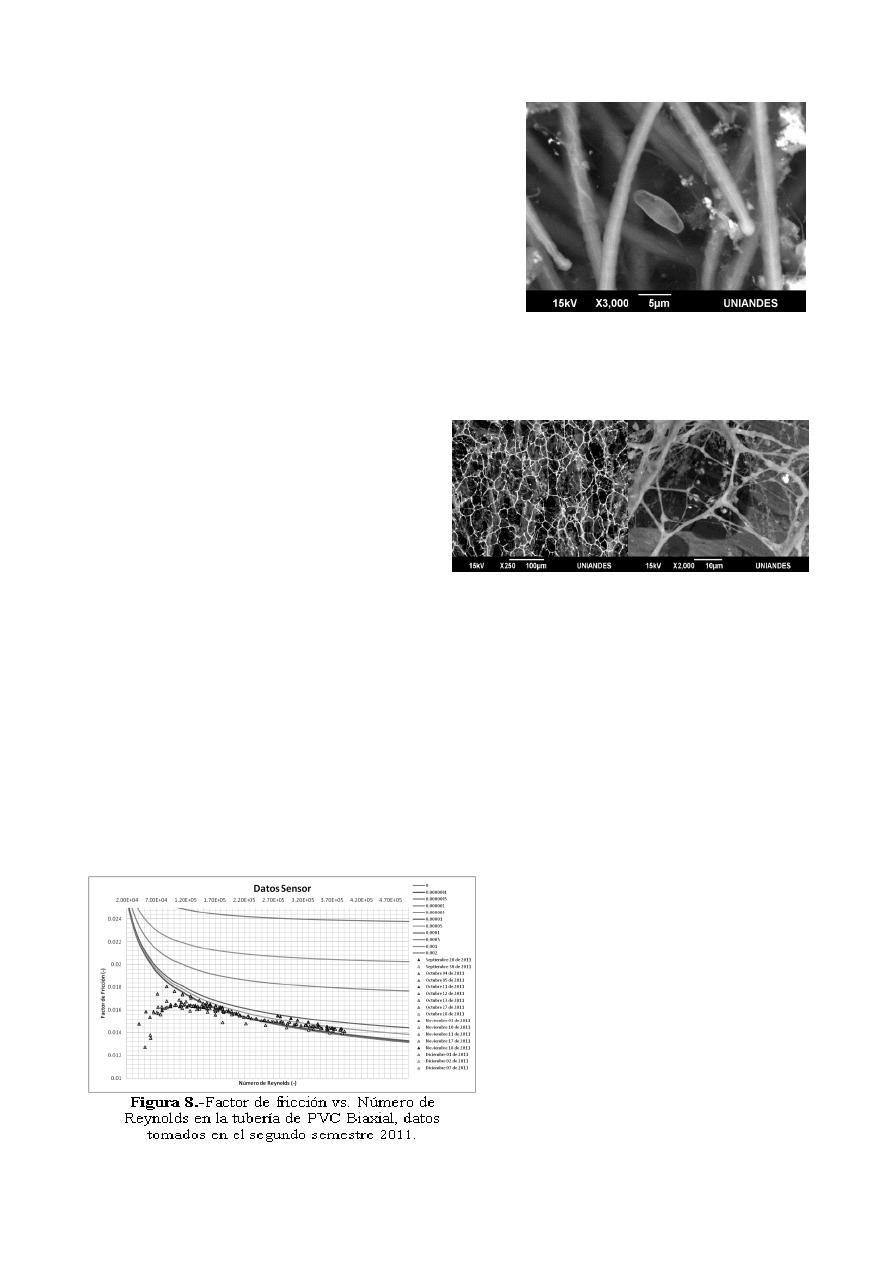
Pérdidas por fricción
En la Figura 8 se puede observar un grupo
de datos que se encuentran en un rango de
tiempo que va desde Septiembre 20 de 2011
hasta Diciembre 7 de 2011. Cuando el
Número de Reynolds es mayor, así como su
caudal, el factor de fricción aumenta de
igual manera. Por el contrario cuando el
flujo es menor y por consiguiente el
Número de Reynolds es menor, su factor de
fricción decrece en comparación con los
anteriores y estos no se ajustan de manera
apropiada al Diagrama de Moody.
Figura 6.-Microfotografía de la
muestra tomada del gavión 1.
Figura 7.-Microfotografía de los testigos. Izq.:
testigo de borde. Der.: testigo de centro número
29.

De esta forma se puede observar que cada vez que se tienen caudales mayores se obtienen
rugosidades absolutas mayores comparadas a las obtenidas cuando se miden datos con caudales más
bajos, pero que se encuentran dentro de lo normal para este tipo de material. Las rugosidades
correspondientes a Números de Reynolds menores, llegan a ser muy pequeñas e incluso negativas
comparadas con los valores reportados para el PVC.
Diagrama de Moody basado en las diferentes ecuaciones desarrolladas.
A lo largo de la historia se han desarrollado diferentes ecuaciones que describen el FTHL; sin
embargo, desde su aparición, estas inducen a un error mínimo el cual ha ido aumentando debido a la
creación de nuevos materiales para las tuberías que son mucho más lisos de los utilizados durante
los estudios que dieron pie al desarrollo de las diferentes ecuaciones.
Las ecuaciones que expresan el límite inferior de la zona de transición, zona de especial
interés para este estudio, se ilustran a continuación y se muestran gráficamente en la Figura 9 dentro
del diagrama de Moody. En ella se pueden ver ligeras variaciones entre los resultados obtenidos por
las diferentes ecuaciones.
Además de poder observar estas diferencias entre las ecuaciones se procedió a analizar los
datos obtenidos durante el estudio en el nuevo Diagrama de Moody, para poder tener un mejor
entendimiento acerca del comportamiento del
factor de fricción y de la rugosidad obtenida.
En la Figura 9 se puede observar la forma en
que algunos datos se ubican en el límite del
Flujo Turbulento Hidráulicamente Liso (FTHL)
establecido por Prandtl (Figura 9, línea naranja),
mientras que hay otros puntos que se ubican
tanto por encima de este límite como por debajo
de éste.
Teniendo en cuenta el comportamiento
de los puntos que representan los datos
registrados durante el tiempo del estudio, se
puede apreciar que todos se encuentran debajo
del límite del FTHL establecido por Colebrook-White (Figura 9, línea roja); por lo tanto la totalidad
de los datos se encuentran por fuera de la zona de transición en el Diagrama de Moody (Figura 9).
Estos resultados son coherentes con los resultados obtenidos en el Diagrama de Moody
convencional (Figura 8), aunque en la Figura 8 no se pueden observar de manera clara los límites de
las diferentes ecuaciones y cómo se distribuyen los datos con respecto a estos autores.
Análisis de Rugosidad
Al obtener datos de las mediciones experimentales de presión y caudal, se pudo realizar el cálculo
respectivo para adquirir el factor de fricción y luego la rugosidad absoluta de la tubería de PVC
Biaxial de 6 pulgadas de diámetro. Al observar estos datos de rugosidad se pueden apreciar que
cuando se toman datos con caudales mayores se obtienen Ks mayores comparadas con las obtenidas
cuando las pruebas se realizaban con caudales más pequeños. En este último caso, se obtuvieron
rugosidades muy pequeñas, cercanas a cero, inclusive rugosidades negativas.
Debido a este fenómeno se procedió a llevar a cabo otro tipo de análisis encontrando una
variable a para entender mejor el comportamiento de estas rugosidades.
Una vez obtenida la rugosidad (Ks), de la manera tradicional, se procedió a calcular la
variable a de la siguiente manera:
[1]
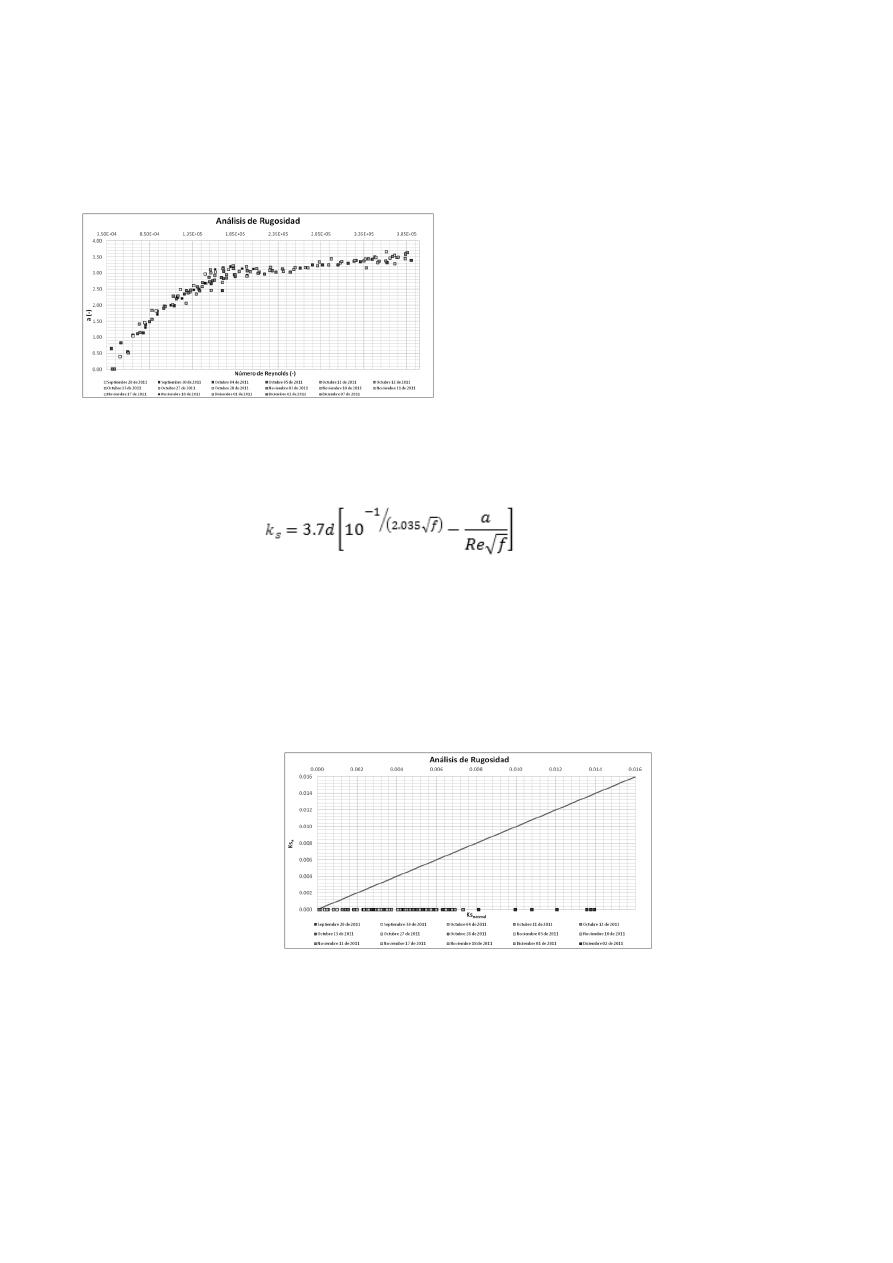
Una vez obtenidos estos resultados se procede a realizar una gráfica a vs. Número de Reynolds
(Figura 10). En la imagen se puede observar como los datos siguen una regresión tipo potencial y se
encuentran dentro de un rango que va desde cero hasta 3.65. A medida que aumenta el Número de
Reynolds la variable a también asciende, pero este fenómeno de crecimiento se puede observar
mejor y más acentuado cuando el Re es menor. Por lo tanto, cuando éste va aumentando el a se
eleva pero con una tendencia a estabilizarse.
Estos resultados de la variable a nunca
sobrepasan el número 4, ni mucho menos el 5.21,
número establecido por Colebrook-White como
límite del FTHL. Esto es coherente con los
resultados obtenidos en los análisis anteriores,
pues en ellos se establece este mismo efecto en el
que los datos no sobrepasan la línea límite del
FTHL establecida por Colebrook-White (Figura
8; Figura 9).
Por otro lado para las rugosidades
positivas obtenidas a partir de los datos
registrados en cada una de las mediciones, se procedió a realizar otro análisis adicional. Una vez
calculada la variable a para Ks positivas se realizó un nuevo procesamiento de datos para obtener
una nueva rugosidad. Este cálculo se realizó siguiendo utilizando la siguiente ecuación:
[2]
Una vez obtenidos estos datos se realizó el diagrama de Ks obtenido a partir de la variable a
(Ks’) vs. Ks obtenido de la manera normal y tradicional, con una línea con un ángulo de 45
o
(Figura
11). En él se puede observar que las rugosidades obtenidas son cero o muy cercanas a este número.
En la Figura 11 se puede observar que todos los puntos se encuentran sobre la línea
horizontal de las abscisas, mostrando que el Ks’ es igual o muy cercano a cero. De esta forma el
análisis muestra que la rugosidad de la tubería no se está percibiendo y podría deberse al PVC y la
forma en que está hecha o al método tradicional en que se está realizando el análisis hidráulico para
calcular la rugosidad absoluta. En otras palabras las pérdidas por fricción están sobreestimadas con
las fórmulas actuales y por lo tanto el diseño de una red es más costoso.
CONCLUSIONES
Aspectos microbiológicos
Se probó tanto la presencia como el crecimiento de algas y cianobacterias dentro del montaje de
recirculación utilizado para este estudio, mediante las pruebas de Microscopía Electrónica de
Barrido (MEB). En ellas se pudo observar diferentes estructuras pertenecientes a algún tipo de
Figura 11.-
Esquema de análisis de Rugosidad, Rugosidad calculada
a partir de a vs. Rugosidad normal.
Figura 10.-
Esquema de análisis de rugosidad, a vs.
Número de Reynolds.

cianobacteria. Estas fueron comparadas con varias microfotografías pertenecientes a la Base de
Datos de Connecticut College llamada The Silica Secchi Disk Database.
En los resultados obtenidos del análisis de los testigos, se pueden observar otras estructuras
filamentosas que posiblemente son organizaciones que pertenecen a fragmentos de agua congelada
debido al método usado para realizar la observación en el microscopio.
Se puede concluir ya que si se detallan los resultados hidráulicos, la rugosidad absoluta que se
obtuvo a lo largo de las pruebas es mucho menor a las reportadas en diferentes estudios con
respecto a la rugosidad de una tubería con biopelícula. Por el contrario esta rugosidad hallada se
encuentra tanto dentro de los valores normales como por debajo de estos. Por lo tanto, es de gran
importancia afirmar que no hubo crecimiento de algas en la superficie interna de la tubería de PVC
Biaxial, y por lo tanto durante el desarrollo de este estudio, no hubo formación de ninguna clase de
biopelícula en la tubería.
Aspectos hidráulicos
Los resultados fueron analizados en el Diagrama de Moody tradicional (Figura 8). A partir de estos
datos se puede observar un comportamiento muy interesante de las condiciones hidráulicas del
montaje. Cuando se tenían caudales relativamente grandes y como consecuencia Números de
Reynolds mayores, se obtuvieron factores de fricción a su vez más grandes. Por el contrario cuando
se tenían Re menores se obtuvo un descenso en el f. Al calcular la rugosidad a partir de estos
factores de fricción obtenidos, se hallaron valores que se encuentran dentro del rango reportado en
la literatura, pero también se aprecian valores mucho más pequeños e incluso negativos en algunos
casos. Estos resultados se encuentran por debajo, sobre y por encima de la línea límite del FTHL
propuesta por Prandtl y Colebrook-White. Esto se puede observar en el Diagrama de Moody
tradicional y en el Diagrama de Moody basado en las diferentes ecuaciones desarrolladas (Figura 8;
Figura 9).
Cuando se analizan los resultados obtenidos por el cálculo de rugosidad absoluta, se puede
ver una relación entre ésta y la ubicación con respecto al límite establecido por Prandtl. Al observar
las rugosidades positivas, se observa que los puntos se ubican por encima del límite de 2.51, pero
cuando las rugosidades son negativas estos datos se ubican por debajo del límite de 2.51. En último
lugar, cuando Ks es tan cercana al cero, estos datos se localizan sobre la línea límite equivalente al
valor teórico de 2.51.
Por otro lado el cálculo de la nueva variable a muestra resultados coherentes con el límite
establecido por la ecuación de Colebrook-White. En ellos se puede observar un rango de valores
entre cero y 3.65, siempre por debajo del 5.21 establecido por este autor (Figura 10). Esto quiere
decir que la ecuación es de tipo conservativo y que solo refleja una línea límite entre la zona de
transición y el FTHL. Debido a que esta ecuación es conservativa se debe reevaluar.
Finalmente, observando la Figura 11, se pueden apreciar nuevos valores de Ks obtenidos a
partir de la variable a calculada. Estos resultados muestran un comportamiento un poco extraño,
pues todos los datos de rugosidad Ks’ (Ks
a
) son iguales a cero, o tan pequeños que se pueden
considerar como cero. Este fenómeno se puede relacionar con el hecho de que hoy en día los
materiales con los que están hechas las tuberías, en este caso específico el PVC, llegan a ser tan
lisos que el análisis convencional que se utiliza para estudiar la hidráulica se queda grande y ya no
se acomoda a las nuevas características. En este caso cuando se calcula la rugosidad, ésta no se
percibe. Es por esta razón que una vez realizados estudios posteriores, de tipo experimental, se
sugiere plantear una nueva ecuación para así poder realizar un análisis apropiado de la rugosidad
para este tipo de materiales de nueva tecnología.

REFERENCIAS
Allen, M.J., Taylor, R.H. & Geldreich, E.E. (1980). The occurrence of microorganisms in water main
incrustations. Journal of American Water Works Association. Vol.72: 614-625.
Clark, G.A., Lamont, W.J., Marr, C.W. & Rogers, D. (1996). Maintaining drip irrigation systems.
Kansas State University.
Clark, G.A., Lamont, W.J., Marr, C.W. & Rogers, D. (1996). Influence of pH and Temperature on the
Survival of Coliform and Enteric Pathogens When Exposed to Free Chlorine. Public Health Reports. USA.
Vol.58.
Codony, F., Miranda, A.M. & Mas, J. (2003). Persistence and proliferation of some unicellular algae in
drinking water systems as result of their heterotrophic metabolism. Water SA. Vol.29: 113-116.
Geldreich, E.E. (1996). Microbial quality of water supply in distribution systems. CRC Press, Boca Raton.
Konjoian, P. (2011). Have algae met their match? OFA Short Course in Columbus, Ohio.
Matheson, D.H. (1952). The effects of algae in water supplies. International Water Supply Association.
Pag. 82.
Ridgway, H.F. & Olson, B.F. (1981). Scanning electron microscope evidence for bacterial colonization of
a drinking-water distribution system. Applied and Environmental Microbiology. Vol.41: 274-287.
Seckbach, J. (2007). Algae and Cyanobacteria in Extreme Environment. Israel: Springer.
Steynberg, M.C., Adam, K. & Pieterse, A.J.H. (1998). An algal monitoring protocol: The strategic link
between reservoir and treatment process. Water, Science and Technology. Vol.37: 153-159.
Steynberg, M.C., Pieterse, A.J. & Geldenhuys, J.C. (1996). Improved coagulation and filtration of algae
as a result of morphological and behavioral changes due to pre-oxidation. Journal of Water Supply:
Research and Technology-Aqua.
Vol.6: 292-298.
The Silica Secchi Disk Database. Andrew Barber director. Connecticut College, United States of
America. [Available online]. Recuperado de la base de datos: http://silicasecchidisk.conncoll.edu/Algal-
ED_finished.html
U. S. Environmental Protection Agency EPA. (2002). Health risks from microbial growth and biofilms in
drinking water distribution systems. Washington D.C.
Van den Hoek, C., Mann, D.G. & Jahns, H.M. (1995). Algae: and introduction to phycology. Cambridge
University Press. Cambridge. (40)
World Health Organization (2003). Guidelines for Safe Recreational Water Environments. Ginebra: WHO
Library Cataloguing-in-Publication Data.
